【トピックス】
ナノゲル工学による人工分子シャペロンの開発
澤田晋一、朝山和喜子、秋吉一成
東京医歯大・生材研
1.はじめに
近年、さまざまな生理活性タンパク質が遺伝子操作により作りだされているが、その際、細胞内で多量に発現させたタンパク質は正しくフォールディングされずに凝集してしまう場合が多い。凝集体として得られたものについては一度、可溶化剤 (塩酸グアニジン、尿素、界面活性剤、カオトロピックイオン) により溶解させ、それらを希釈や透析などの手段により取り除くことで目的のタンパク質を得ることが行われている1)。しかし、満足のいく収量は得られていない。人工機能タンパク質の創成やポストゲノム研究と関連してタンパク質の折り畳み制御の問題はバイオテクノロジー分野での重要な課題である。
生体系では、タンパク質を凝集から守る分子シャペロンとよばれる一群のタンパク質が存在している。コロイド化学的には、タンパク質の凝集を防ぐ安定化剤といえる。しかし、分子シャペロンは、単にタンパク質の凝集を抑制しているのみならず、その誕生から死までの一生にわたりタンパク質のお世話をするバイオナノマシンである。生体の分子シャペロン機能は、in vitroでのタンパク質フォールディング問題の解決に大きなヒントを与えてくれる。分子シャペロンは、おもに疎水的な会合力を利用して非天然状態のタンパク質を認識して相互作用し、無秩序な不可逆的なタンパク質間の凝集を防いでいる。そして、必要な時にATPやコシャペロンといわれる制御タンパク質の力を借りて非天然タンパク質との会合、修復、放出、他の機能タンパク質への受け渡しなどを行っている2)。
我々は分子シャペロンの発現メカニズムに立脚した分子シャペロンインスパイアードマテリアルを設計し、効果的にタンパク質の巻き戻しが行える新規な系の開発を行っている。本稿では、その一端を紹介する。
2.人工分子シャペロンの設計
人工分子シャペロンの基本設計にあたっては、1) 高分子のホスト– ゲスト系の確立、2) 高分子間会合の動的制御、3) 非天然タンパク質の認識が重要である。これらの因子を組み込んだ人工分子システムとして、ここではタンパク質のホストとして機能する自己組織化ナノゲルを用いた人工分子シャペロンの設計概念とその機能について紹介する。
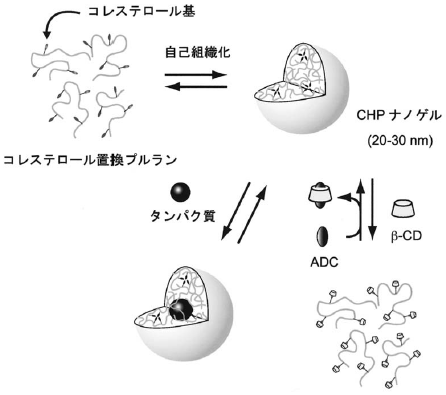
我々は、会合性高分子の自己組織化を利用することで、タンパク質と相互作用し得るナノ空間を有する両親媒性のナノゲルを構築 (自己組織化ナノゲル法、図1) できることを明らかとした3-7)。タンパク質と同様に高分子の会合性因子として“のり”の役割を果たす疎水性分子を水溶性高分子に少しだけ導入した疎水化高分子は、水中でヒドロゲル構造を有するナノ微粒子を形成した8)。多糖以外にもポリリジンやポリグルタミン酸などを用いた疎水化ポリアミノ酸9)や熱応答性の疎水化ポリイソプロピルアクリルアミドおよびそれらのハイブリッドナノ粒子10)なども開発している。これらのナノゲルは、ドラッグキャリアーシステムとしても有用である11)。
図1 疎水化多糖の自己組織化と複合化
疎水化多糖 (コレステロール置換プルラン、CHP) からなるナノゲルは、分子シャペロンと同様に天然状態タンパク質よりも熱変性タンパク質やリフォールディング中間体とより強く相互作用しえることが分かった。先に述べたように分子シャペロンはATPの結合と加水分解により、ホストのコンフォメーションを周期的に変化させ、基質タンパク質の結合と解離を制御している。ATPを用いた高分子間会合制御の方法論は、生体系では普遍的にみられる一般原理の一つであるが、人工系では実現が難しい課題である。我々は、シクロデキストリン (CD) をナノゲルの構造変化のモデュレーターとして用いる方法を開発した12)。CDはナノゲル中の疎水基と包接錯体を形成し架橋点を破壊することで、ナノゲルを崩壊させる。ナノゲルとタンパク質との複合体にCDを添加すると、タンパク質が放出されるとともに自発的に巻き戻り、その活性が回復してくることがわかった13-15)。また、最近では光応答性ナノゲルを用いたシステムも考案した16)。以下、具体的にその例を紹介しよう。
3.疎水化多糖ナノゲルシステム
a) 酸変性緑色蛍光タンパク質 (GFP) の再生
酸変性GFPのリフォールディング実験は、大腸菌由来の分子シャペロンであるGroEL-ATP (シャペロニン) 系の作用機構解析のために用いられてきた。この実験系で、天然シャペロンと人工シャペロンの機能比較を行った。酸変性GFP のリフォールディングは、酸変性させたGFPをGroELおよびCHPナノゲルを含む溶液で100倍希釈して中性状態に戻し、一定時間後にATPあるいはmethyl-β-CD (シクロデキストリン) を添加して、GroEL、CHPナノゲルからGFPを放出させて行った。GFPの各時点でのリフォールディング率は、蛍光強度を励起波長398 nm、蛍光波長508 nmで経時的に測定し、未変性GFPの蛍光強度までの回復率から求めた。
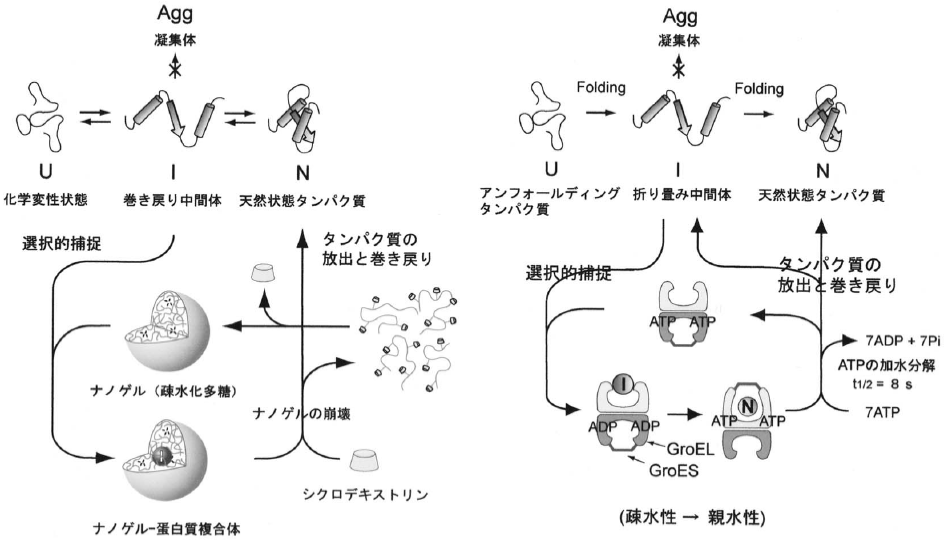
自発的なリフォールディングでは約70%まで活性が回復した。一方、GroELとCHP存在下では蛍光が見られず、いずれも変性したGFPをトラップしていることが示唆された。GroEL系にATPを添加するとリフォールディングが開始され、20分後に約70%まで達した。一方、ナノゲルではCDを添加すると、10分以内に約90%まで蛍光が回復した。このように、CD添加後の蛍光強度の回復速度はGroELより速く、活性回復率も高いことがわかった。酸変性GFPのリフォールディングにおいては、ナノゲル系はGroEL系に匹敵する高いシャペロン活性を示すことが明らかになった。ナノゲル系とシャペロニン系の作用機序を (図2) に示す。
図2 ナノゲル系とシャペロニン系の作用機序
b) 化学変性タンパク質の再生
凝集体からのタンパク質の再生では、化学変性剤による可溶化と変性剤除去によるリフォールディングシステムが一般的である。この系のモデルタンパク質としてarbonic Anhydrase B (CAB) を用いた系について検討した。CAB (30 mg/mL) を6.0 M 塩酸グアニジン (GdmCl) により化学変性 (16時間) させ、これをナノゲルを含まない50 mM Tris-sulfate buffer (pH 7.5) を用いて1000倍希釈し、リフォールディングを行うと白濁し沈殿した。酵素活性を測定したところ約20%のリフォールディングしか行えなかった。一方、CHPナノゲル水溶液 (5.0 mg/mL) を含むbufferを用いて同様に希釈するとタンパク質の凝集が抑制された。疎水化多糖ナノゲルとCABの複合体が形成していることが明らかになった。この複合体に、種々のCDを添加すると、複合体の崩壊とともにタンパク質のリフォールディングが起こり、酵素活性が回復した。酵素活性の回復率は、疎水化多糖の種類、添加するCDの種類と濃度に依存した (~80%)。四次構造をとるCitrate Synthase (CS)、さらにある種の大腸菌由来のタンパク質封入体 (インクルージョンボディー) の巻き戻りにも効果があることも明らかになった。
このように、疎水基の会合領域をゲルの架橋点とする自己組織化ナノゲルが、非天然状態タンパク質と選択的に相互作用すること、さらにこの疎水化多糖の会合と解離をCDにより制御して、タンパク質の放出と巻き戻りを制御し得た。
4.in vitro転写/翻訳システムでの人工分子シャペロン機能
ナノゲルは、非天然状態タンパク質と選択的に相互作用するという、天然シャペロンと同様な興味ある機能を有している。ナノゲルは無細胞タンパク質合成系 (E.coli 由来cell freeタンパク質合成系) の合成を阻害することなく、シャペロン機能を発現することが期待できる。ナノゲル存在下あるいは非存在下でのGFPの発現を蛍光強度の時間変化を追跡することで評価した。ナノゲル非存在下でGFPの発現を行うと、時間とともに蛍光強度が増大し、約400分間で蛍光強度の増加は飽和に達した。一方、ナノゲル存在下でGFPの発現を行うと、時間変化にも関わらず全く蛍光強度の増大が確認されなかった。しかし、ここにmethyl-β-CDを添加したところ、蛍光強度の増大が確認できた。ナノゲルが折り畳み過程にあるGFPをトラップし、methyl-β-CDを添加することでナノゲルが崩壊し、トラップされていたGFPが放出され、それとともに天然型へのフォールディング、発光団の形成が起こり蛍光を発するようになったといえる。この際、ナノゲルは本来のタンパク質合成を阻害しないこともわかった。in vitro転写/翻訳システム系でも生成タンパク質の凝集が問題となっており、本系は合成タンパク質の再生、精製にも有効であると思われる。
5.光応答性人工分子シャペロン
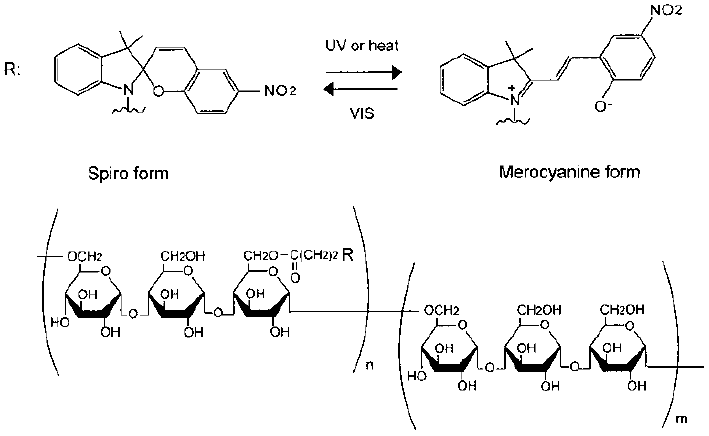
スピロピランは、フォトクロミズムに伴って親水性・疎水性の変換や大きな構造変化を引き起こす化合物である。従来の疎水基に変えて高分子の会合制御因子として、この分子を多糖に部分置換したスピロピラン置換プルラン (SpP ;図3) は水中でナノゲルを形成した。SpPナノゲルのシャペロン作用を、モデル酵素としてCSを用いて検討を行った。SpPナノゲルはそのコンフォメーションによらず、天然状態のCSの酵素活性に影響を及ぼさなかった。CS (1.0 mg/mL) を6.0 M GdmClによって変性させ、50倍希釈によるリフォールディング実験を行った。本条件下では、CSは自発的には30%しかリフォールディングしなかった。同一条件下、メロシアニン (Mer) 型のSpPナノ微粒子を調製し暗所下においてリフォールディングを行わせると、顕著なシャペロン活性を示した (~60%)。さらに、Mer型でリフォールディングを開始し、暗所下で30分ほど放置した後に、可視光照射しSpiro型に変換した系では、非常に大きなシャペロン活性を示した (~80%)。このようにSpPはスピロピラン基の親水性・疎水性を光照射により制御することで高いシャペロン作用を示す新しいシステムとして機能することが明らかになった16)。
図3 スピロピラン置換プルランの構造
6.おわりに
疎水化多糖からなるナノゲルは分子シャペロンと類似の機能を発現し得ることが明らかとなった。ナノゲルはタンパク質の変性中間体と選択的に相互作用し, 変性タンパク質同士の不可逆的な凝集を抑制し、シクロデキストリン添加によりナノゲルが崩壊するとともにタンパク質は放出され、同時に折り畳みが進行してタンパク質が再生する。この系はナノゲルおよびCDの種類を調整することで様々なタンパク質に対応した人工分子シャペロンが設計し得る。ナノゲル固定化カラムへの展開を図っている。また、光応答性人工分子シャペロンは次世代型の高機能性シャペロンとして興味深い。ポストゲノム研究や医学・薬学分野におけるタンパク質機能解析の重要な技術として汎用性のある人工分子シャペロンの研究を展開している。
文献
1) Orsini, G., Goldberg, M. E.: J. Biol. Chem., 253, 3453 (1978).
2) 永田和宏、森正 敬、吉田賢右共著: 分子シャペロンによる細胞機能制御, シュプリンガー・フェアラーク東京(2001).
3) 秋吉一成: 化学フロンティア5 生命化学のニューセントラルドグマ, 化学同人, 160 (2002).
4) 秋吉一成、野村雄太: 日本DDS学会誌, 17, 486 (2002).
5) Nishikawa, T., Akiyoshi, K., Sunamoto, J.: J. Am. Chem. Soc., 118, 6110 (1996).
6) Nishikawa, T., Akiyoshi, K., Sunamoto, J.: Macromolecules, 27, 7654 (1994).
7) Lee, I., Akiyoshi, K.: Biomaterials, 25, 2911 (2004).
8) Akiyoshi, K., Deguchi, S., Tajima, H., Nishikawa, T., Sunamoto, J.: Macromolecules, 30, 857 (1997).
9) Akiyoshi, K., Ueminami, A., Kurumada, S., Nomura, Y.: Macromolecules, 33, 6752 (2000).
10) Akiyoshi, K., Kang, E.-C., Kurumada, S., Sunamoto, J., Principi, T., Winnik, F. M.: Macromolecules, 33, 3244 (2000).
11) Ikuta, Y., Katayama, N., Wang, L., Okugawa, T., Takahashi, Y., Schmitt, M., Gu, X., Watanabe, M., Akiyoshi, K., Nakamura, H., Kuribayashi, K., Sunamoto, J., Shiku, H.: Blood, 99, 3717 (2002).
12) Kuroda, K., Fujimoto, K., Sunamoto, J., Akiyoshi, K.: Langmuir, 18, 3780 (2002).
13) Akiyoshi, K., Sasaki, Y., Sunamoto, J.: Bioconjugate Chem., 10, 321 (1999).
14) Akiyoshi, K., Ikeda, M., Sasaki, Y., Sunamoto, J.: Stud Surf Sci Catal, 132, 89 (2001).
15) Nomura, Y., Ikeda, M., Yamaguchi, N., Aoyama, Y., Akiyoshi, K.: FEBS Lett., 553, 271 (2003).
16) Hirakura, T., Nomura, Y., Aoyama, Y., Akiyoshi, K.: Biomacromolecules, 5, 1804 (2004).