【トピックス】
耐塩性乳酸菌の分子シャペロン
杉本真也、中山二郎、園元謙二
九大院・農
1.はじめに
乳酸菌は古来より発酵食品の製造に用いられており、人間の営みに深く関わりあっている微生物である。現在では、乳酸菌が生産するバクテリオシンを用いたバイオプリザベーションおよびプロバイオティクスとしての応用性が注目されている。耐塩性乳酸菌Tetragenococcus halophilus(旧名Pediococcus halophilus) の耐塩性は他の乳酸菌と比べて非常に高く、0.5 Mから3.0 M NaCl濃度条件下でよく生育し、26% (4.5 M) 程度のNaCl濃度がその生育限界である1)。その優れた耐塩性からT. halophilusは、実際に醤油醸造過程において、耐塩性酵母とともに乳酸などの有機酸類、アルコール類を生産し、醤油特有のフレーバーや色を形成することに貢献している。
乳酸菌の耐塩性機構としては、グリシンベタインなど適合溶質の取り込みや生合成、イオンチャンネルによるイオン恒常性の維持、細胞膜脂肪酸組成の変化が知られている2)。T. halophilusは外界の塩濃度が上昇した場合、菌体内のナトリウムイオン濃度を一定に保ち高濃度のカリウムイオンを蓄積すると報告されている3)。筆者らは上記のような条件下での生命維持に必要な種々の細胞内タンパク質の高次構造維持や、新生タンパク質の正しいフォールディングに分子シャペロンが関与していると考え、T. halophilusの耐塩性と分子シャペロンの機能との関連性、さらにその応用について研究を行っている。本稿では、筆者らのこれまでの研究の一端を紹介する。
2.環境ストレスと分子シャペロン
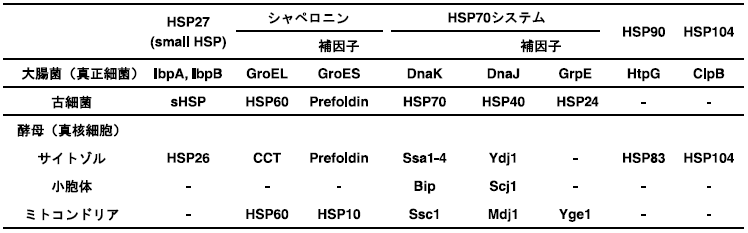
自然界で生育する細菌は常に環境ストレスとの戦いの中にあり、細胞内タンパク質は常に高次構造の変化に伴う変性などの危険性を孕んでいる。細菌は生育に不都合な環境におかれた場合、自己防衛機構を素早く働かせて自らを守ろうとする。その代表的なものとして、分子シャペロンによるタンパク質の細胞内制御機構が挙げられる4)。分子シャペロンの多くはヒートショックタンパク質 (Heat Shock Protein: HSP) であり、熱をはじめとして塩、pHなどのストレス条件に応じて一過的に合成される5)。また分子シャペロンは、ストレス状態のみならず通常の生育条件下においても構成的に発現しており、新生タンパク質のフォールディング、変性タンパク質の凝集阻害、タンパク質輸送などタンパク質の一生のうちあらゆる局面で重要な生理機能を発揮する6)。分子シャペロンには幾つかのファミリーが存在しており (表1)、筆者らはなかでも代表的なHSP70ファミリーに属するDnaK、HSP60ファミリーに属するGroELの構造と機能および遺伝子発現制御機構について研究してきた7-9)。
表1 微生物の主要な分子シャペロン
3.耐塩性乳酸菌の分子シャペロン遺伝子のクローニング
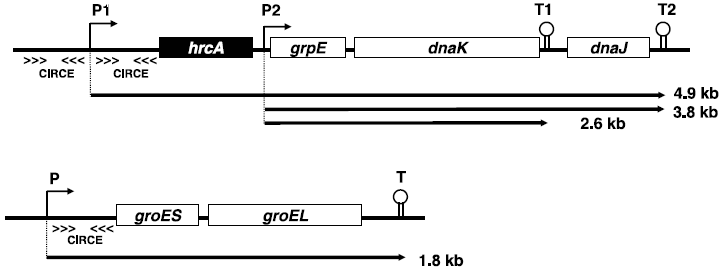
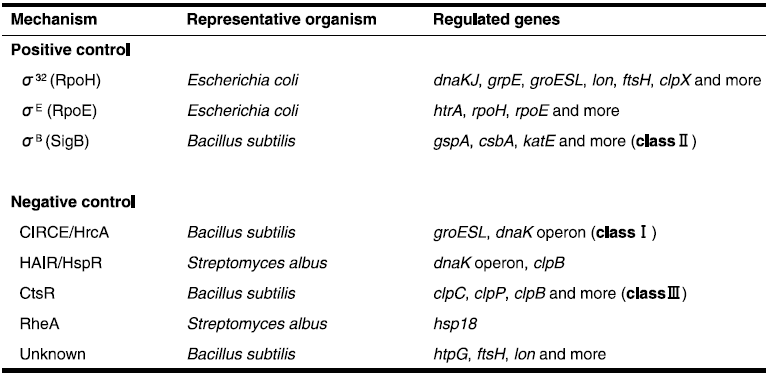
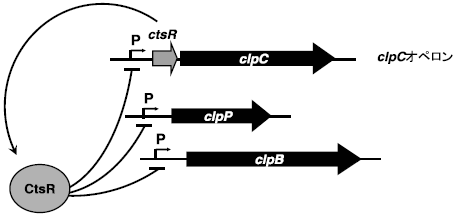
筆者らはこれまでに、T. halophilusから細菌の代表的な分子シャペロンであるdnaKおよびgroEL遺伝子のクローニング、およびその近傍の遺伝子解析を行った (図1)。いずれも他種グラム陽性細菌と同様、その近傍の遺伝子構造も類似しておりdnaKの上流にはリプレッサータンパク質遺伝子hrcA(heat regulation at CIRCE) およびgrpE、下流にはdnaJに高い相同性を示すopen reading frameの存在が確認された (図2)。groELに関しては、その上流にgroESに高い相同性を示すopen reading frameが存在した。これらの遺伝子はいずれもEnterococcus属由来のものと最も高い相同性を示した。また、hrcA上流に2つ、groES上流に1つのCIRCE (Controlling Inverted Repeat of Chaperone Expression) 配列が見出され、他種グラム陽性細菌の分子シャペロン同様、HrcA/CIRCEシステム (クラスⅠ型レギュロン、表2) による遺伝子発現制御の存在が示唆された (図3)。さらに最近では、DnaKと協調して働くことで凝集体のリフォールディングを促進するHSP104/ClpBという分子シャペロンの遺伝子クローニングと塩基配列の決定を行った。その結果、T. halophilus clpBはdnaK、groELと同様にEnterococcus属が保持するclpBと最も高い相同性を示した。また、プロモーター領域の塩基配列の比較より、この遺伝子はDnaK、GroELオペロンとは異なり、リプレッサータンパク質CtsR (class three stress gene repressor、クラスⅢ型レギュロン、表2) によって遺伝子発現が制御されていることが推定された (図4)。乳酸菌や枯草菌などのグラム陽性細菌では、このCtsRがClpファミリーに属するATP依存性プロテアーゼをコードする遺伝子の上流に位置するプロモーター領域に結合して、転写を負に制御することが明らかとなっている10,11)。


表2 真正細菌の熱誘導遺伝子の発現制御機構


4.塩ストレスによるdnaK, groEL遺伝子の発現誘導
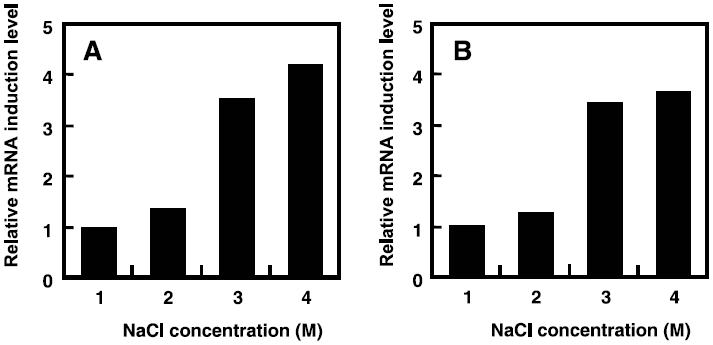
ノーザン解析によりそれぞれの分子シャペロン遺伝子の転写解析を行った結果、groES-ELはオペロンとして転写されていることが明らかとなった (図1)。また、このgroES-ELオペロンは4 M NaClを含む培地中で1時間培養すると、1 M NaClの場合に比べて約4倍転写増幅されることがスロットブロット解析により明らかとなった7)(図5A)。一方、dnaKおよびその近傍の遺伝子に関しては、dnaKに相補するプローブを用いたノーザン解析により、複数のmRNAの存在が確認され、ポリシストロン性の転写様式をとることが明らかとなった (図1)。また、T. halophilus菌体にとって最適な生育NaCl濃度である2 Mまでは大きな発現量の変化は見られなかったものの、3~4 M NaClにおいては、通常時の約3.5倍の転写量の増大が確認された8)(図5B)。これらの結果、分子シャペロンDnaKおよびGroELがT. halophilusの高塩濃度適応において何らかの重要な役割を果たしていることが示唆された。

5.dnaK, groELオペロンの転写制御機構
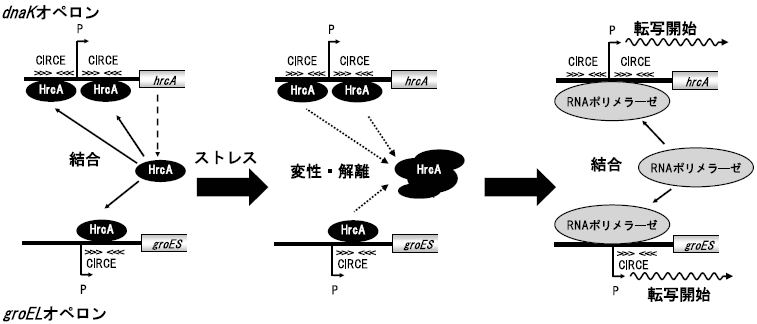
枯草菌などの研究では、dnaKおよびgroEL遺伝子の転写制御は、先に述べたとおりHrcAがStem-loop構造をとったCIRCE配列へ結合することにより負に制御されていることが示唆されている (図3)12)。T. halophilusにおいても同様の制御機構が存在すると考え、組換え体HrcAを用いてゲルシフトアッセイおよびビオチン化CIRCE DNA断片への結合実験を行った。その結果、HrcAがdnaK遺伝子クラスター上流およびgroES上流に存在するCIRCE部位に特異的に結合することが示された。また、ゲルシフトアッセイとCDスペクトル解析の結果より、熱ストレスと塩ストレスによってHrcAの立体構造変化が生じ、HrcAのDNAへの結合活性は失われることが明らかとなった。
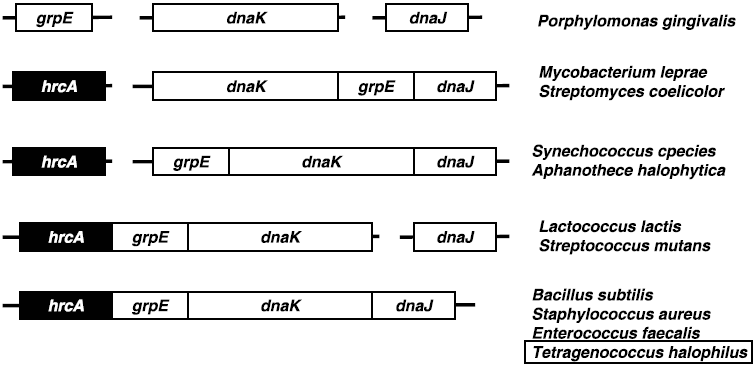
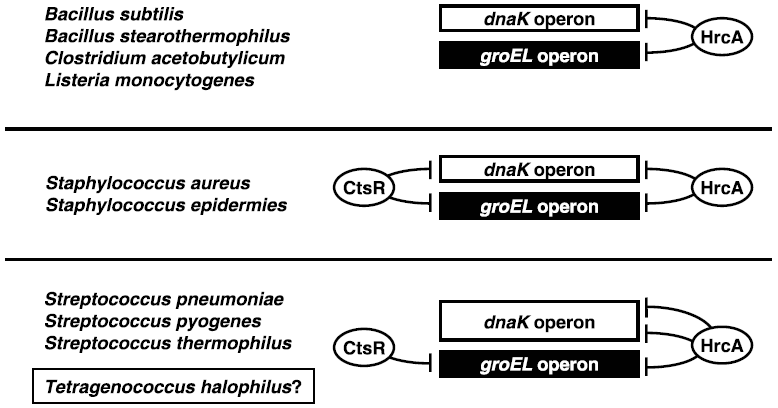
また、一部のグラム陽性細菌の中には、リプレッサータンパク質CtsRがClpファミリーの遺伝子のみならず、dnaKおよびgroELオペロンの遺伝子発現を制御しているものも存在する (図6)13)。Bacillusタイプの場合、dnaKおよびgroELオペロンの遺伝子発現はHrcAによって制御されているが、Staphylococcusタイプの場合は、dnaKおよびgroELオペロンの両方がHrcAとCtsRの二重制御を受けている。一方、Streptococcusタイプの場合は、groELオペロンのみがHrcAとCtsRによって二重に制御されている。Streptococcusタイプのもう一つの特徴として、dnaKオペロン上流にCIRCE配列が二つ存在するということが挙げられ、そのためにCtsRの制御を受ける必要がないと考えられている13)。T. halophilusはdnaKオペロン上流に二つのCIRCE配列を有しているが、groELオペロン上流にはCtsR結合配列は見出されておらず、必ずしもStreptococcusタイプとは言い難い。DnaK、GroEL、ClpB以外の分子シャペロンの転写制御機構を明らかにしていきながら、CIRCE配列が二つ存在する理由・意義については今後明らかにしていきたい。

6.耐塩性乳酸菌分子シャペロンの機能と応用性
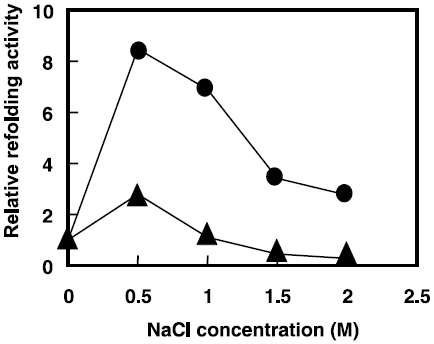
我々は、in vitroでのT. halophilus Dnakの機能を解析するために、dnaK遺伝子をpET発現ベクターに組込み、大腸菌を形質転換した。大腸菌内で大量発現させたDnaKを精製し、尿素で変性した乳酸脱水素酵素を基質として様々な塩ストレス条件下においてリフォールディング活性を測定した。その結果、非耐塩性乳酸菌Lactococcus lactissubsp. lactis由来のDnaKと比較して高塩ストレス条件下において高いリフォールディング活性を示した (図7)9)。現在、DnaKと同様に精製した組換え体DnaJ、GrpEを用いて高塩濃度下でのシャペロン活性を検討しており、高塩濃度下でも効率的に変性タンパク質を再生できるシャペロンシステムの構築をめざしている。

T. halophilus GroELに関しても、DnaK同様in vitroでの機能解析を行うために大腸菌内で大量発現を試みた。その結果、大量発現と精製には成功したものの、そのほとんどが14量体からなるリング構造を形成しなかった。この原因としては、大腸菌内で大量発現させることにより、過剰な濃度となったGroELが凝集してしまったことや、複合体形成に高濃度の塩が必要であるということが予想されている。T. halophilus GroELのin vitroで詳細な機能解析のためには、正常な構造をとったGroEL の取得が必要であり、今後さらに複合体形成の条件検討ならびに高塩濃度条件下での詳細な機能解析を行う予定である。
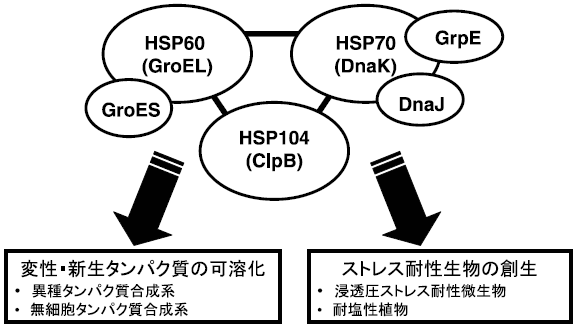
耐塩性乳酸菌の分子シャペロンの応用性としては、以下の二つのことが考えられる (図8)。第一に、大腸菌や酵母を用いた異種タンパク質合成系において頻繁に生じるインクルージョンボディー (不溶性凝集体) の可溶化への応用である。一部のタンパク質に関しては、大腸菌由来の分子シャペロンを共発現することによりインクルージョンボディーの形成を抑制することに成功したという報告例もあるが14-16)、未だインクルージョンボディーの形成は組換えタンパク質を利用する研究者の悩みの種となっている。また、その有用性から近年注目されている無細胞タンパク質合成系においてもインクルージョンボディーの形成は重大な問題となっているらしい。高塩菌由来のタンパク質は、その安定性に塩を必要とし、それなしではインクルージョンボディーを形成してしまう。このようなタンパク質を異種タンパク質合成系や無細胞タンパク質合成系において生産する場合、当然高濃度の塩を加える必要がある。このとき著者らが研究している高塩菌由来の分子シャペロンを共存させれば、変性/新生タンパク質の凝集阻害やリフォールディングによって成熟構造のタンパク質が増加すると考えられる。
図8 耐塩性乳酸菌分子シャペロンの応用性
第二に、耐塩性・浸透圧ストレス耐性生物の創生への応用である。穀物生産においては、人口爆発と地球環境の破壊による食糧不足を解決するために砂漠や塩類集積土壌などの未耕地土壌の利用と環境ストレスに抵抗性のある植物の作出が必要である。一方、微生物による発酵生産において究極の最適化がなされている現在では、過剰な基質濃度と高濃度の最終生産物によるストレスが発酵生産の限界を生んでいる。浸透圧ストレス耐性遺伝子を導入することでそれら発酵に関わる物質耐性を向上させることができれば、生産性の限界を超えることが可能であると考えられる。古来より発酵食品の製造に利用され、安全性・無害性が実証されている耐塩性乳酸菌の分子シャペロンは、耐塩性植物や浸透圧ストレス耐性微生物の創生へ応用できると期待している。
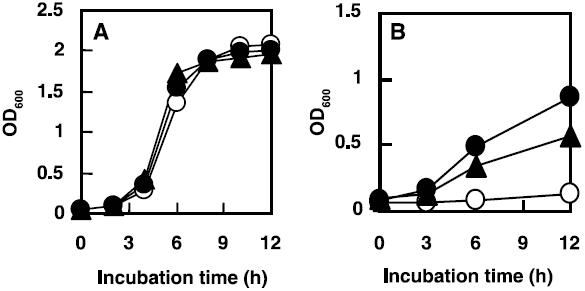
実際に我々は、T. halophilus Dnakを大腸菌内においてヘテロ発現することで、組換え大腸菌の耐塩性が向上するかその生育を検討した (図9)9)。非ストレス条件下 (1% NaCl) では、ベクターコントロールとT. halophilus Dnak発現株および比較に用いた非耐塩性乳酸菌L. lactis DnaK発現株の生育に顕著な差は見られなかった。これに対し、5% NaCl 以上の高塩ストレス条件下では、コントロールにおいて大幅な増殖の遅れが確認されたが、T. halophilus Dnak発現株とL. lactis DnaK発現株では増殖の遅れは見られなかった。T. halophilus Dnak発現株とL. lactis DnaK発現株を比較すると、T. halophilus Dnak発現株のほうが最大OD値は高く、高塩ストレスに適応能が高いことが示された。また、これら2株のDnaK発現量には顕著な差が認められなかったことから、T. halophilus Dnakの持つ高塩濃度条件下のシャペロン機能によって大腸菌の耐塩性が向上することが明らかとなった。

7.おわりに
これまでの検討によって、耐塩性乳酸菌の分子シャペロン遺伝子の発現制御機構が明らかになりつつある。またDnaK遺伝子を大腸菌へ導入することで耐塩性の向上に成功した。DnaKと協調して働くコシャペロンDnaJ、GrpEあるいはGroESLとClpBを共発現させることができれば、さらに宿主の耐塩性は強化されるはずである。筆者らは現在、耐塩性菌の分子シャペロンDnaK、DnaJ、GrpEおよびGroESL、ClpB共発現プラスミドを構築し、遺伝子操作が容易に行える大腸菌へ導入することでインクルージョンボディーの可溶化と耐塩性・浸透圧ストレス耐性微生物の創生への応用性を評価している。今後は、これら耐塩性乳酸菌の分子シャペロン遺伝子をモデル植物であるシロイヌナズナへ導入し、耐塩性植物を創生したいと考えている。また、分子シャペロンは様々なストレスに応答して一過的に合成されるタンパク質であることから、これを利用することによりある特定のストレスのみならず種々のストレスに対して耐性を持つマルチストレス耐性生物の創生が可能であると期待している。
いまや分子シャペロンは、タンパク質のフォールディングを助ける役割を持つ、いわば“舞台裏の功労者”から、あらゆる細胞機能の制御に関わる“名脇役”として脚光を浴び、その重要性がますます認識されてきた。そして分子シャペロン研究は、分子・細胞生物学、構造生物学、進化生物学といった基礎的な研究から、臨床医学、産業への応用と多岐にわたっている。今後もこの魅惑的な“名脇役”を基礎と応用という二つの視点から見つめ、更なる研究の進展に尽力していきたいと考えている。
謝辞
本研究の一部は日本学術振興会科学研究費補助金を受けて行われました。心より感謝申し上げます。
文献
1) Röling, W. F. M., Van Verseveld, H. W.: Appl. Environ. Microbiol., 62, 1203 (1996).
2) Guchte, van de M., Serror, P., Chervaux, C., Smokvina, T., Ehrlich, D. S., Maguin, E.: Antonie van Leeuwenhoek, 82, 187 (2002).
3) Tsao, L., Hua, J. J.: Chinese J. Microbiol. Immunol., 23, 87 (1990).
4) Hartl, F. U., Hartl, M. H.: Science, 295, 1852 (2002).
5) Lindquist, S., Craig, E. A.: Annu. Rev. Genet., 22, 631 (1988).
6) Hartl, U. F.: Nature, 381, 571 (1996).
7) Fukuda, D., Watanabe, M., Aso, Y., Sonomoto, K., Ishizaki, A.: Biosci. Biotechnol. Biochem., 66, 1176 (2002).
8) Fukuda, D., Watanabe, M., Sonezaki, S., Sugimoto, S., Sonomoto, K., Ishizaki, A.: J. Biosci. Bioeng., 93, 388 (2002).
9) Sugimoto, S., Nakayama, J., Fukuda, D., Sonezaki, S., Watanabe, M., Sonomoto, K.: J. Biosci. Bioeng., 96, 129 (2003).
10) Varmanen, P., Ingmer, H., Vogensen, F. K.: Microbiology, 146, 1447 (2000).
11) Derrè, I., Rapoport, G., Msadek, T.: Mol. Microbiol., 31, 117 (1999).
12) Schulz, A., Schumann, W.: J. Bacteriol., 178, 1088 (1996).
13) Chastanet, A., Whitfield, C.: Mol. Microbiol., 47, 1061 (2003).
14) Nishihara, K., Kanemori, M., Kitagawa, M., Yanagi, H., Yura, T.: Appl. Environ. Microbiol., 64, 1694 (1998).
15) Nishihara, K., Kanemori, M., Kitagawa, M., Yura, T.: Appl. Environ. Microbiol., 66, 884 (2000).
16) Kurokawa, Y., Yanagi, H., Yura, T.: J. Biol. Chem., 276, 14393 (2001).