【トピックス】
最近の人工シャペロン系の展開
山口哲志、長棟輝行
九大・先導研、東大院・工
1.はじめに
ヒトをはじめとした各種生物のゲノム解読終了後、各遺伝子にコードされるタンパク質の構造解析や機能解析が進められている。このようなポストゲノムの研究においては、解析に十分な量の天然型タンパク質をいかに迅速・低コストに生産するかが重要となる。また今後、ポストゲノムの研究成果を基にタンパク質性医薬品の開発がさらに活発になることが予想される。このような背景から、天然型の目的タンパク質を高効率に生産する技術が強く求められている。
近年、酵母や昆虫細胞などを宿主としたタンパク質発現系も用いられるようになったが、安価・簡便・迅速に増殖でき、高濃度発現が可能である大腸菌を宿主とした発現系は、現在でも最も使用頻度の高い発現系である1)。特に、翻訳後修飾を必要としない場合は、最初に宿主として選択されるのは大腸菌である場合が非常に多い。しかしながら、大腸菌に大量発現させたヒトや植物由来の異種タンパク質は、しばしば菌体内で不溶性の封入体になる2)。そのため、封入体を可溶化した後、可溶化タンパク質を天然型構造に誘導するリフォールディング操作が必要となる。
一方、発現条件によってその割合は変わるものの3)、封入体は目的タンパク質によってその大部分が占められている凝集体であるため、封入体としてのタンパク質発現には、以下のような多くの長所もある1)。(1) 高密度大量発現を可能にする。(2) 目的タンパク質の回収・精製が簡便に行える。(3) 細胞内での目的タンパク質のプロテアーゼ分解を抑制できる。(4) 宿主細胞に対する毒性、致死性を有するタンパク質の発現を可能にする。特に、タンパク質を商業ベースで生産する場合、ダウンストリーム工程において目的タンパク質を大量処理することが可能となり、大量生産システムの設計が容易になる。以上の利点から、現在、成長ホルモンであるBovine somatotropinが、封入体からのリフォールディングによって年間数10 kg生産されている4)。
このような背景から、封入体からのリフォールディング法が、盛んに研究されている2-5)。本稿では、リフォールディングの効率を向上させるために用いる添加剤についての研究を紹介する。特に、近年、バイオミメティックスを志向し、生体内でタンパク質のフォールディングを介助している分子シャペロンやフォールダーゼの機能を模倣した添加剤の開発が試みられている。そこで、特に、そのような人工シャペロン系の最近の展開について解説したい。
2.従来のリフォールディング法とその問題点
まず、従来から一般的に行われているリフォールディング法について、簡単に解説する。ほぼ全ての手法において、リフォールディングは、尿素や塩酸グアニジン (GdnHCl)、dithiothreitol (DTT) といった可溶化剤の濃度を下げることによって行われる。なぜなら、これらの可溶化条件下では、立体構造形成に必要な分子内相互作用も弱められてしまうため、タンパク質は天然型構造を形成できず、柔軟性の高い構造未形成状態となる5)。そこで、分子内相互作用および分子内S-S結合が形成できる濃度条件まで可溶化剤濃度を下げることによって、可溶化タンパク質のリフォールディングを誘導するというわけである。しかしながら、可溶化剤濃度の低下は、天然型構造の形成に必要な分子内相互作用を可能にするが、同時に、誤った分子内相互作用や分子間相互作用も可能にする。そのため、タンパク質のリフォールディングは、可溶化タンパク質から天然型への単一反応ではなく、ミスフォールディングや再凝集との競争反応となる。特に、可溶化剤濃度の低い条件においていったん形成された再凝集産物は、自発的に解離することはないため、再凝集反応は不可逆である5)。この不可逆的な再凝集反応は、リフォールディング収率の著しい低下を招くため、再凝集反応の抑制がリフォールディングの最大の課題である。
大希釈法は、その簡便性のために古くから用いられ、現在においても、リフォールディング手法として最も使用頻度の高い手法である。操作は非常に単純で、可溶化タンパク質水溶液を、生理条件の緩衝液 (リフォールディング緩衝液) によって100~1000 倍に希釈するだけである。この手法では、希釈によって可溶化剤濃度の低下が実現するとともに、タンパク質濃度も著しく低下する。ここで、凝集反応速度はタンパク質濃度の2乗以上に比例して変化するのに対し、リフォールディング速度は1乗に比例する6)。そのため、タンパク質濃度が十分に低くなるまで希釈すれば (<10~20µg/ml)、凝集を抑制しつつリフォールディングすることが可能となる7)。しかしながら、工業的な観点から考えると、大容量の装置と大量の添加剤を必要とし、また、リフォールディング後に濃縮ステップが加わるという問題点がある2)。さらに、大希釈法では、再凝集反応をほとんど抑制できず、生産効率が悪い場合も多く報告されている。
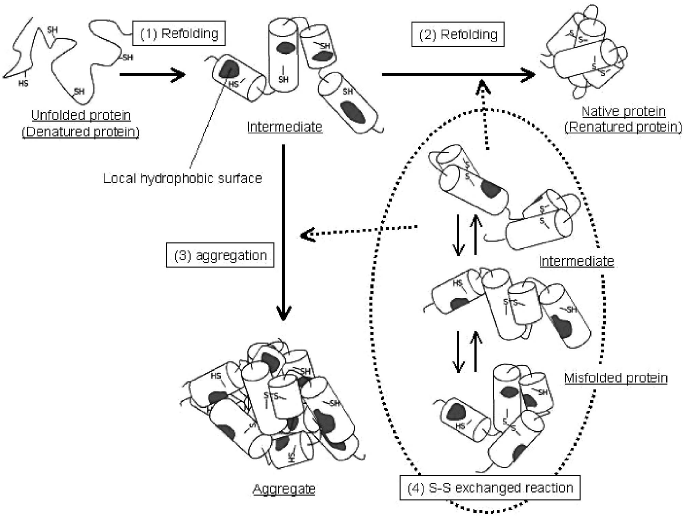
再凝集反応が起こりやすく、リフォールディングが困難なタンパク質は、そのリフォールディング過程において、凝集性のリフォールディング中間体を経ることがしばしば報告されている8)。このリフォールディング中間体は、分子内水素結合により二次構造は形成しているが、疎水性相互作用による三次構造のパッキングがされていない、いわゆる、「モルテン・グロビュール状態」であることが様々な解析法により証明されている9)。これらの知見から、リフォールディング反応と再凝集反応との競争反応のモデルとして、次のモデルが最も一般的である (図1)。(1) まず、可溶化剤濃度の低下によって迅速に二次構造が形成され、局所的に疎水性の高い表面を有するリフォールディング中間体が生じる。次に、(2) リフォールディング中間体の疎水性表面間の分子内疎水性相互作用により、天然型タンパク質へとリフォールディングされる反応と、(3) リフォールディング中間体の分子間疎水性相互作用により、タンパク質凝集体が形成される反応との競争反応が起こる。つまり、このリフォールディング中間体から天然型へのリフォールディング反応 (図1(2)) が遅いタンパク質は、比較的低いタンパク質濃度においても、凝集反応 (図1(3)) が支配的になってしまう。
図1 リフォールディング反応と凝集反応との競争反応の概念図
リフォールディング反応に、誤ったS-S結合の架け替え反応 (S-S交換反応、図1(4)) や、プロリン異性化反応を含むタンパク質の場合、リフォールディング中間体からのリフォールディング速度が格段に遅くなることが報告されている10)。したがって、このようなタンパク質のリフォールディングは、凝集反応が支配的になる場合が多く、大希釈法ではリフォールディング収率が著しく低くなってしまう。ここで、サイトカイン等の機能性の分泌タンパク質は、立体構造の安定化のために、天然型構造に多くのS-S結合を含むことが知られている11)。つまり、ポストゲノムの研究において、またタンパク質性医薬品の大量生産において、リフォールディングのターゲットとなるタンパク質は、ほとんどリフォールディング反応にS-S交換反応を含んでいると言っても過言ではない。したがって、リフォールディング中間体の凝集を効果的に抑制し、リフォールディング収率を高める技術が強く求められている。
3.低分子量化合物および親水性ポリマーの添加
リフォールディング収率を高めるために、これまでに、リフォールディング緩衝液中に加える添加剤が盛んに検討されてきた。添加剤として、もっとも古くから研究されてきたのが、低分子量化合物や親水性ポリマーである (表1)。これらの添加剤は、そのリフォールディングに与える効果を基に、フォールディング促進剤と凝集抑制剤の2つに大別できる。フォールディング促進剤としては、タンパク質間相互作用を促進させ、天然型構造を安定化する糖類や塩12)、S-S交換反応を開始・促進する低分子量チオール類13)が用いられている。特に、天然型構造に複数のS-S結合を有するタンパク質のリフォールディングでは、誤ったS-S結合を再度切断してS-S交換反応を開始させるためにシステインや還元型グルタチオンといった還元剤の添加が必須である。さらに、シスチンや酸化型グルタチオンなどの酸化剤を、還元剤と適当な比率で合わせて添加することにより、空気酸化に比べてS-S交換反応の速度が上がることが広く知られている。このように、フォールディング促進剤は、凝集性リフォールディング中間体からのリフォールディング速度を上げることにより、リフォールディング収率を向上させる。
表1 リフォールディング添加剤とその使用例
凝集抑制剤としては、尿素やGdnHClなどのカオトロピック試薬を低濃度条件で添加する手法が一般的である。カオトロピック試薬は、可溶化剤として古くから用いられてきたが、2.5 M以下の適当な濃度でリフォールディング緩衝液に添加すると、凝集反応のみを効率良く阻害する場合があることが明らかとなった14)。また、現在、最も使用頻度の高い凝集抑制剤として、L-アルギニン塩酸塩がある15)。L-アルギニン塩酸塩のリフォールディング介助機構については、諸説が混在しているのが現状であるが、低濃度のGdnHClとほぼ同じ働きをしているというのが一般的である。GdnHClと比べてタンパク質の立体構造を破壊する効果が小さいため、凝集抑制剤としてより適しているという報告もある16)。その他にも、脂肪鎖の短いアルコールを適切な濃度で添加すると、収率が向上することが明らかにされている17)。
各種の界面活性剤やポリエチレングリコール (PEG)、シクロデキストリン、などが、凝集抑制剤として、リフォールディング収率を改善することが報告されている18)。これらの凝集抑制剤は、タンパク質の疎水性表面と相互作用することによって凝集反応を阻害すると考えられている。一方、リフォールディング中間体に結合した凝集抑制剤は、凝集反応のみでなく、リフォールディング反応をも阻害することが知られている2d)。そのため、添加量を最適化しないとリフォールディング収率の低下を招くことが多く、効果のある狭い添加条件を煩雑な条件検討により探し出す必要がある18e)。そこで、適切な相互作用によって、凝集は抑制するがリフォールディング速度にはあまり影響を与えない添加剤の開発が試みられており、タンパク質の結晶化促進剤として開発されたsulfobetaineが、そのような効果を有しているという報告もある19)。
以上のように、既往の研究によって、低分子量の汎用試薬の中から、リフォールディング収率を向上させる試薬が多く見つかっている。しかしながら、その効果は、タンパク質の種類や濃度条件によって大きく変わるため、添加剤の種類の選択、添加濃度の決定には煩雑な条件検討が必要であると言える。
4.人工シャペロン系
低分子量化合物や合成高分子を用いて、天然の分子シャペロンやフォールダーゼの機能を模倣する試みがなされている。ここで、界面活性剤や酸化還元試薬といった従来の低分子量添加剤によっても、分子シャペロンやフォールダーゼの有する機能はある程度再現されてはきた。しかし、近年、バイオミメティックスを志向し、より高度な機能を模倣した手法、合成添加剤が開発されている。そこで、それらの研究をまとめて紹介する。
4.1 分子シャペロンの模倣
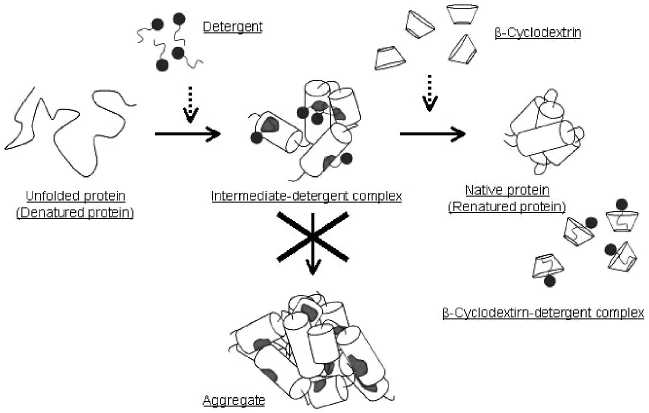
1995年、Gellmanらによって、二種類の低分子量化合物を順次添加することにより、分子シャペロン様のリフォールディング促進効果が見られることが発見され、この手法は、Artificial Chaperone-Assisted refolding (ACA) 法と名付けられた21)。ACA法では、まず、界面活性剤を添加することによってリフォールディング中間体の凝集を抑制し、次に、界面活性剤のホスト化合物の添加によりタンパク質表面から迅速に界面活性剤を除去し、リフォールディングを開始する (図2)。一方、生体内では、大腸菌の場合、分子シャペロンの一つであるDnaKが、DnaJと伴にフォールディング中間体タンパク質の疎水性表面に強く結合し、凝集を阻害する。その後、GrpEタンパク質によって、この複合体が解離し、適切なフォールディングが開始されることが知られている22)。つまり、ACA法は、複合体形成による凝集阻害とその後の複合体の解離という二つの役割を、それぞれ低分子量化合物によって再現し、大腸菌のDnaK-DnaJ-GrpEシステムを模倣しているというわけである。
図2 界面活性剤とシクロデキストリンとを用いた人工シャペロン系の概念図
Gellmanらは、カルボニックアンヒドラーゼBをはじめとして、構造的に異なる種々のタンパク質に対してACA法を行い、高いリフォールディング収率が得られることを報告した21)。このように、比較的安価な添加剤を用いて汎用性良くリフォールディング収率が向上させられるという利点から、近年、他の研究グループによってもACA法は盛んに研究、応用されている3)。ホスト化合物については、Gellmanらが用いたβ-シクロデキストリンの水溶性が低いことから、より水溶性の高い高重合度シクロアミロースを用いた例23)や直鎖状デキストリンを用いた例が報告されている24)。また、モデル変性タンパク質のみでなく、封入体からのリフォールディングにACA法を用いた実用例も既に報告されている25)。また、このような実績から、町田らの研究グループは商品化に成功しており、タカラバイオ(株)よりACA法を基にしたリフォールディング用キットとして販売されている。
この他、天然シャペロンの持つ様々な性質を模倣した添加剤が開発されている。秋吉らは、疎水化プルランからなるナノゲルを用いて、GroEL-GroESシステムのコンパートメント効果の模倣に成功した26)。また、後藤らによっても、逆ミセル中でリフォールディングを行う方法27)が、GroEL様のコンパートメント効果を期待した手法として提案されている。一方、天然シャペロンが局所的に疎水性の高い表面をもつことに着目した研究も報告されている。久保井らのグループは、リポソーム表面がGroELと同様のリフォールディングに適した疎水性環境を有することから、添加剤として用いることにより収率の向上に成功した28)。また、同グループは、最近では、熱感受性のブロックコポリマー (ポリプロピレン-フェニル-ポリエチレングリコール) が、ある温度・濃度条件でGroEL様の疎水性表面を保持し、添加剤として非常に有効であることを報告している29)。
4.2 フォールダーゼの模倣
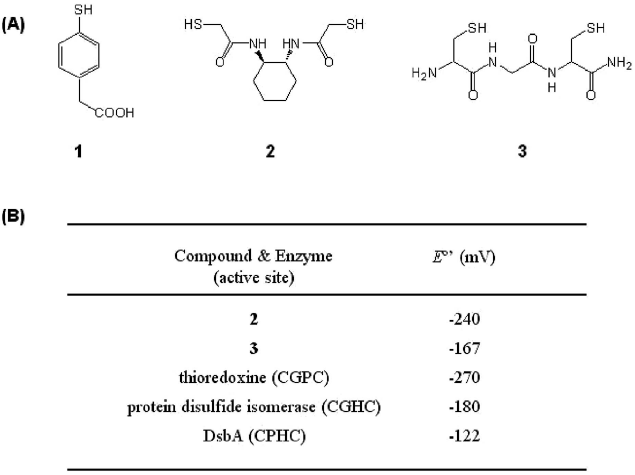
フォールダーゼを模倣した研究として、S-S交換反応を促進するジスルフィドイソメラーゼ (PDI) 様の機能を有した低分子量化合物が研究・開発されてきた。Leesらは、PDIの活性中心にあるチオール基のpKaに着目した研究を行った30)。PDIの活性中心にあるCXXCモチーフのチオール基のうち、溶液中に露出しているチオール基は、pKaが低く (pKa =6.7)、基質タンパク質のS-S結合に対する求核性が高いことが知られている。そこで、システインらの脂肪族チオールよりもpKaが低い芳香族チオール (図3 化合物1) を開発し、変性還元リボヌクレア-ゼAのリフォールディングに添加剤として用いた。その結果、S-S交換反応速度が速くなり、リフォールディング速度が大きく向上することを報告した。一方、Rainesらは、生体内においてタンパク質の酸化還元反応を触媒している酵素群の酸化還元電位に着目し、適切な電位を有する低分子量化合物 (図3 化合物2) およびペプチド (図3 化合物3) を、S-S交換促進試薬として開発した31)。これらの化合物を添加したところ、従来の酸化還元試薬を添加した場合と比較して、変性還元リボヌクレア-ゼAのリフォールディング収率は向上することが示された。
![]()
5.人工シャペロン系の固相化
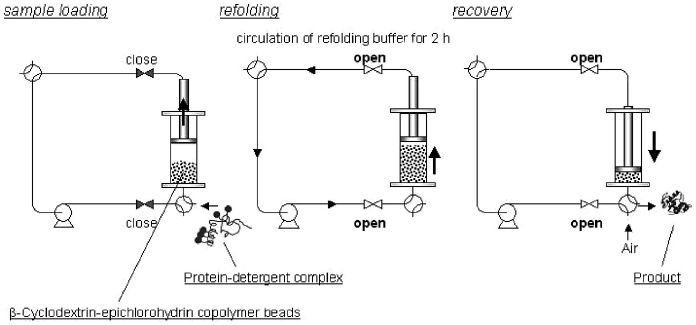
工業スケールへの応用を考えると、タンパク質のリフォールディング技術には、以下のような条件を満足することが望まれる。(1) 装置の大きさができるだけ小さい。(2) 工程数ができるだけ少ない。(3) 材料が再利用可能である。このような観点から、機能性添加剤を固相上に固定化する研究が盛んに行われている。なぜなら、添加剤の固相上への固定化は、カラムを用いた連続系リフォールディングシステムへの応用を可能とすることから、潜在的に装置のサイズを小さくでき、リフォールディング後の添加剤とターゲットタンパク質の分離精製工程を簡略化し、材料の再利用を可能にするという利点を有するからである。我々の研究グループでは、β-シクロデキストリンを含むポリマービーズ (β-シクロデキストリン-エピクロロヒドリンコポリマー) を用いて、ACA法を固相化することに成功した32)。まず、可溶化モデルタンパク質を界面活性剤水溶液で希釈することにより、界面活性剤との複合体を形成させ、次に、β-シクロデキストリンを含むポリマービーズ懸濁液を添加して、界面活性剤を包接除去した。このような二段階の操作により、モデルタンパク質である変性α-グルコシダーゼのリフォールディング収率を大きく向上させた。さらに、膨張層式カラム内でポリマービーズによる包接を行う反復回分系のACA法の構築も実現した (図4)。また、他のグループでは、久保井らは、リポソームを固定化したカラムに、変性・還元リゾチームを通すことによって100%の収率でリフォールディングに成功しており28)、PDI様活性を模倣した低分子量チオール化合物を固相上に固定化した研究も、数例報告されている33)。
![]()
6.おわりに
本稿では、封入体から効率良く目的タンパク質を回収するために新しいリフォールディング技術が必要であることを明確にした上で、リフォールディング収率を向上させる人工添加剤の研究について、実用的な観点からその効果や問題点を中心に紹介した。特に、バイオミメティクスを志向した人工シャペロン系については、より詳細に紹介し、また、固相系への応用といった最近の動向についても触れた。
リフォールディング収率の向上を実現する上で、最も問題となるのは、リフォールディング中間体の疎水性表面に見られる二面性である。リフォールディング中間体の疎水性表面は、リフォールディング中間体の不可逆的な凝集を引き起こす主要因となる反面、天然型のコンパクトな立体構造をとるために必須でもある。つまり、収率低下の原因となる凝集を妨げるために、添加剤を用いて疎水性表面間の相互作用を阻害すると、同時にリフォールディングをも妨げることになるので厄介である。一方、生体は、天然の分子シャペロン群を巧みに操り、複数のステップを踏んでこの難問を解決している。そこで、本稿で紹介したような人工シャペロン系が盛んに研究されてきたが、今後は、これまでの人工シャペロン系を基に実用化可能な系へと改良する研究と、新たな機能性材料を用いた人工シャペロン系の開発とが進められるであろう。最近では、刺激応答性のポリマーや分子集合体、ヒドロゲル、膜といった様々な機能性材料が開発されていることから、これらの新世代材料を用いた新たな人工シャペロン系が次々に構築されことが期待される。
文献
1) 越塚規弘: 生物化学実験法45「組換えタンパク質生産法」,学会出版センター (2001).
2) a) Baneyx, F.: Curr. Opin. Biotech., 10, 411 (1999). b) Clark, E. D. B.: Curr. Opin. Biotech., 12, 202 (2001). c) Rudolph, R., Lilie, H.: FASEB J., 52, 49 (1996). d) Clark, E. D. B., Schwarz, E., Rudolph, R.: Methods Enzymol., 309, 217 (1999).
3) Valax, P., Georgiou, G.: Biotechnol. Prog., 9, 539 (1993).
4) Georgiou, G., Valax, P.: Methods Enzymol., 309, 48 (1999).
5) Tsumoto, K., Ejima, D., Kumagai, I., Arakawa, T.: Protein Expres Purif., 28, 1 (2003).
6) a) Phadtare, S., Alsina, J., Inouye, M.: Curr. Opin. Microbiol., 2, 175 (1999). b) Vasina, J. A., Baneyx, F.: Protein Expres. Purif., 9, 211 (1997).
7) Middelberg, A. P. J.: TRENDS Biotech., 20, 437 (2002).
8) a) Hevehan, D. L., Clark, E. D.: Biotechnol. Bioeng., 54, 221 (1997). b) MaachupalliReddy, J., Kelley, B. D., Clark, E. D.: Biotechnol. Prog., 13, 144 (1997).
9) a) Bam, N. B., Cleland, J. L., Randolph, T. W.: Biotechnol. Prog., 12, 801 (1996). b) Cleland, J. L., Wang, D. I. C.: Biochemistry, 29, 11072 (1990). c) Goldberg, M., Rudolph, R., Jaemicke, R.: Biochemistry, 30, 2790 (1991). d) Uversky, V. N., Ptitsyn, O. B.: J. Mol. Biol., 255, 215
(1996).
10) Altamirano, M. M., Garcia, C., Possani, L. D., Fersht, A. R.: Nature Biotech., 17, 187 (1999).
11) Fahey, R. C., Hunt, J. S., Windham, G. C.: J. Mol. Evol., 10, 155 (1977).
12) a) Michaelis, U., Rudolph, R., Jarsch, M., Kopetzki, N., Burtscher, H., Shumacher, G.: U. S. ptatent, 5, 434,067 (1995). b) Chang, B. S., Beauvais, R. M., Arakawa, T., Narhi, L. O., Dong, A. C., Aparisio, D. I., Carpenter, J. F.: Biophs J., 71, 3399 (1996). c) Goto, Y., Ichimura, N., Hamaguchi, K.: Biochemistry, 27, 1670 (1988).
13) a) Sela, M., White, F. H., Anfinsen, C. B.: Science, 16, 691 (1957). b) Ahmed, A. K., Schaffer, S. W., Watlaufer, D. B.: J. Biol. Chem., 250, 8477 (1975). c) Raman, B., Ramakrishna, T., Rao, D. M.: J. Biol. Chem., 271, 17067 (1997).
14) Dong, X., Shi, J., Sun, Y.: Biotechnol. Prog., 18, 663 (2002).
15) Arora, D., Khanna, N.: J. Biotechnol., 52, 127 (1996).
16) 津本浩平, 三沢 悟, 熊谷 泉: 生物物理40, 274 (2000).
17) Wetlaufer, D. B., Xie, Y.: Protein Sci., 4, 1535 (1995).
18) a) Tandon, S., Horowitz, P. M.: J. Biol. Chem., 262, 4486 (1987). b) Huxtable, S., Zhou, H. Q., Wong, S., Li, N.: Protein Expres. Purif., 12, 305 (1998). c) Kim, C. S., Lee, E. K.: Process Biochem., 36, 111 (2000). d) Cleland, J. L., Wang, D. I. C.: ACS Symposium. Ser., 516, 151 (1993). e) Tandon, S., Horowitz, P. M.: Biochim. Biophys. Acta, 955, 19 (1988). f) Zardeneta, G., Horowitz, P. M.: J. Biol. Chem., 267, 5811 (1992). g) Karuppiah, N., Sharma, A.: Biochem. Biophys. Res. Co., 211, 60 (1995).
19) Vuillard, L., Rabilloud, T., Goldberg, M. E.: Eur. J. Biochem., 256, 128 (1998).
20) Samuel, D., Kumar, T. K. S., Ganesh, G., Jayaraman, G., Yang, P. W., Chang, M. M., Trivedi, V. D., Wang, S. L., Hwang, K. C., Chang, D. K., Yu, C.: Protein Sci., 9, 344 (2000).
21) a) Rozema, D., Gellman, S. H.: J. Am. Chem. Soc., 117, 2373 (1995). b) Rozema, D., Gellman, S. H.: J. Biol. Chem., 271, 3478 (1996). c) Rozema, D., Gellman, S. H.: Biochemistry, 35, 15760 (1996).
22) Richardson, A., Landry, S. J., Georgopoulos, C.: Trends Biochem. Sci., 23, 138 (1993).
23) a) Machida, S., Ogawa, S., Xiaohua, S., Takaha, T., Fujii, K., Hayashi, K.: FEBS lett., 486, 131 (2000). b) 町田幸子, 林 清: 生物物理, 42, 246 (2002).
24) Sundari, C. S., Raman, B., Balasubramanian, D.: FEBS lett., 443, 215 (1999).
25) a) Xie, J., Li, D., Zhang, J., Zhao, J.: New J. Chem., 27, 395 (2003). b) Xie, Q. H., Matsunaga, S., Shi, X. H., Ogawa, S., Niimi, S., Wen, Z. S., Tokuyasu, K., Machida, S.: Protein Express. Purif., 32, 68 (2003).
26) Nomura, Y., Ikeda, M., Yamaguchi, N., Aoyama, Y., Akiyoshi, K.: FEBS Lett., 553, 271 (2003).
27) Sakono, M., Goto, M., Furusaki, S.: J. Biosci. Bioeng., 89, 458 (2000).
28) Kuboi, R., Yoshimoto, M., Walde, P., Luisi, P. L.: Biotechnol. Prog., 13, 828 (1997).
29) Yoshimoto, N., Hashimoto, T., Felix, M. M., Umakoshi, H., Kuboi, R.: Biomacromol., 4, 1530 (2003).
30) Gough, J. D., Williams, R. H., Donofrio, A. E., Lees, W. J.: J. Am. Chem. Soc., 124, 3885 (2002).
31) a) Woycechowsky, K. J., Wittrup, K. D., Raines, R. T.: Chem. Biol., 6, 871 (1999). b) Woycechowsky, K. J., Raines, R. T.: Biochemistry, 42, 5387 (2003).
32) a) Mannen, T., Yamaguchi, S., Honda, J., Sugimoto, S., Nagamune, T.: J. Biosci. Bioeng., 91, 403 (2001). b) Yamaguchi, S., Chai, H., Mannen, T., Tsukiji, S., Nagamune, T.: Biotechnol. Lett., in press.
33) a) Woycechowsky, K. J., Hook, B. A., Raines, R. T.: Biotechnol. Prog., 19, 1307 (2003). b) Shimizu, H., Fujimoto, K., Kawaguchi, H.: Colloids Surf. A, 153, 421 (1999). c) Shimizu,
H., Fujimoto, K., Kawaguchi, H.: Biotechnol. Prog., 16, 248 (2000).